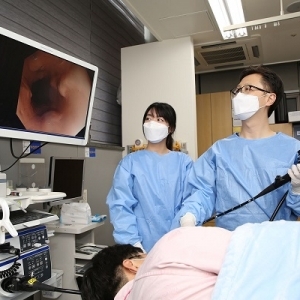
[박광준 기자] 방역당국은 2일 미국 식품의약국(FDA)에서 긴급사용 승인이 난 코로나 바이러스 감염증 치료제 ‘렘데시비르’의 특례수입을 신속히 진행할 수 있도록 대비하고 있다고 밝혔다.
권준욱 중앙방역대책본부 부본부장은 이날 정례브리핑에서 “렘데시비르의 특례수입절차를 빠르게 진행하는 방안에 대해 충분히 대비하고 진행하고 있다”고 말했다.
약사법에 의하면, 특례수입조항에 해당하면 국내 품목 허가나 신고가 되지 않은 의약품도 제조.수입이 가능하게 된다.
렘데시비르는 길리어드사이언스가 에볼라 치료제로 개발해온 항바이러스제로, 최근 미국에서 진행한 초기 임상시험에서 코로나 치료에 효과가 나타났다는 발표가 나오면서 주목을 받았다.권 부본부장은 “FDA 긴급사용 승인은 정식 사용 승인은 아니다. 코로나 중증인 환자의 치료에 국한해 사용할 수 있게 된 것”이라고 설명하고, “관계 당국.부처와 긴밀히 협조하고 전문가들과 논의하면서 렘데시비르 임상 시험 결과를 정리하겠다”고 밝혔다.
권 부본부장은 “임상시험 결과는 전문가들의 영역이다. 일부는 통계학적인 유의성에 의문을 표시하는 전문가들도 있다”면서도, “그런데도 현재 상황에서 권위 있는 미국 FDA가 렘데시비르의 긴급사용을 승인했다는 것의 큰 의미를 인지하고 있다”고 덧붙였다.
FDA는 1일(현지 시각) 렘데시비르의 긴급사용 승인을 발표하면서 호흡 장애로 인공호흡기 등을 필요로 하는 코로나 중증 입원 환자를 위해 특별히 지정될 것이라고 전했다.
FDA의 긴급사용 승인은 연구가 진행 중인 상황에 취할 수 있는 조처로, 정식 사용허가와는 다르다. 다만 긴급사용 승인이 나면 처방은 가능하다.
 수요일 아침을 여는 K-브런치 콘서트 '우.아.한'
[민병훈 기자] 대전시립연정국악원(이하 국악원)은 오는 29일 오전 11시 국악원 작은마당에서 올해 세 번째 2024 기획시리즈 K-브런치콘서트‘우.아.한(우리의 아침을 여는 한국음악)’공연을 개최한다. 이번 공연에는 전통음악을 바탕으로 재즈, 레게 등 장르를 넘나들면서 활발히 활동하고 있는 소리꾼 김율희가 나온다. KBS 국악대상 판...
수요일 아침을 여는 K-브런치 콘서트 '우.아.한'
[민병훈 기자] 대전시립연정국악원(이하 국악원)은 오는 29일 오전 11시 국악원 작은마당에서 올해 세 번째 2024 기획시리즈 K-브런치콘서트‘우.아.한(우리의 아침을 여는 한국음악)’공연을 개최한다. 이번 공연에는 전통음악을 바탕으로 재즈, 레게 등 장르를 넘나들면서 활발히 활동하고 있는 소리꾼 김율희가 나온다. KBS 국악대상 판...

 천안서북소방서, 전기자동차 운행.충전 안전하게
천안서북소방서, 전기자동차 운행.충전 안전하게
 중고거래 이용자에게 종합소득세 안내문 발송
중고거래 이용자에게 종합소득세 안내문 발송
 중기부, 인도네시아 자카르타서 한.아세안 스타트업 정책대화
중기부, 인도네시아 자카르타서 한.아세안 스타트업 정책대화
 전북대, ‘K-방산’ 선도 위해 세계적 기관과 연대 강화
전북대, ‘K-방산’ 선도 위해 세계적 기관과 연대 강화
 용인시외국인복지센터, 베트남 전통 음식 행사 개최... 문화 다리 놓다
용인시외국인복지센터, 베트남 전통 음식 행사 개최... 문화 다리 놓다
 한길타임즈 CG
한길타임즈 CG
 [신간] 지오북 ‘데이비드 애튼버러의 주 퀘스트’ 출간
[신간] 지오북 ‘데이비드 애튼버러의 주 퀘스트’ 출간
 에스파, 수록곡 ‘Licorice’로 감초처럼 달콤+톡 쏘는 매력 선사
에스파, 수록곡 ‘Licorice’로 감초처럼 달콤+톡 쏘는 매력 선사
 2024 의왕시장애인 한마음체육대회 개최
2024 의왕시장애인 한마음체육대회 개최
 [칼럼] 5.18에 생각하는 총선 승리
[칼럼] 5.18에 생각하는 총선 승리
 北京 징 산 공원(景山公园) 에서 내려다본 고궁
北京 징 산 공원(景山公园) 에서 내려다본 고궁

 목록으로
목록으로